

1 重症肌无力概述
重症肌无力(myasthenia gravis,MG)是由自身免疫抗体介导的获得性神经-肌肉接头(neuromuscular junction,NMJ)传递障碍的自身免疫性疾病。
目前,MG患者血清中发现的与神经⁃肌肉接头结构或骨骼肌胞质成分相关的自身抗体达10余种,包括:
| 乙酰胆碱受体(AChR)抗体 | |
| 突触受体关联蛋白(rapsyn)抗体 | |
| 低密度脂蛋白受体相关蛋白4(LRP4)抗体 |
乙酰胆碱受体(AChR)抗体是最常见的致病性抗体;此外,针对突触后膜的其他组分,包括肌肉特异性受体酪氨酸激酶(MuSK)、低密度脂蛋白受体相关蛋白(LRP4)及兰尼碱受体(RyR)等也参与MG的发生。这些抗体可干扰AChR聚集,影响AChR功能及NMJ信号传递。
MG全球患病率为(150-250)/百万,预估年发病率为(4-10)/百万。我国MG发病率约为0.68/10万,女性发病率略高;住院死亡率为14.69‰,主要死亡原因包括呼吸衰竭、肺部感染等。
MG各个年龄段均可发病,30岁和50岁左右呈现发病双峰,中国儿童和青少年MG(JMG)患病率高达50%,构成第三个发病高峰;JMG以眼肌型为主,很少向全身性转化。最新流行病学调查显示,我国70-74岁年龄组为高发人群。
全身骨骼肌均可受累,表现为波动性无力和易疲劳性,症状呈“晨轻暮重”,活动后加重、休息后可减轻。
眼外肌最易受累,表现为对称或非对称性上睑下垂和/或双眼复视,是MG最常见的首发症状,见于80%以上的MG患者。
面肌受累可致眼睑闭合无力、鼓腮漏气、鼻唇沟变浅、苦笑或呈肌病面容;咀嚼肌受累可致咀嚼困难;咽喉肌受累可出现构音障碍、吞咽困难、鼻音、饮水呛咳及声音嘶哑等;颈肌受累可出现抬头困难或不能。
肢体无力以近端为著,表现为抬臂、梳头、上楼梯困难,感觉正常;呼吸肌无力可致呼吸困难。
发病早期可单独出现眼外肌、咽喉肌或肢体肌肉无力;脑神经支配肌肉较脊神经支配肌肉更易受累。肌无力常从一组肌群开始,逐渐累及到其他肌群,直到全身肌无力。部分患者短期内病情可出现迅速进展,发生肌无力危象。
旨在评估疾病严重程度,指导治疗及评估预后(表1)。疾病严重程度可根据定量MG评分(quantitative MG score,QMGS)评估(表2)。
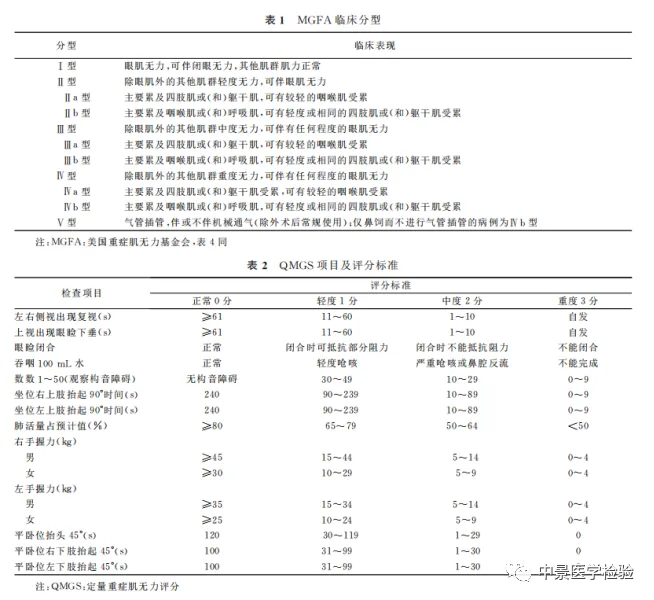
MG临床表现具有极大异质性,以血清抗体及临床特点为基础的亚组分类,对MG个体化治疗及预后评估更具指导意义(表3)。
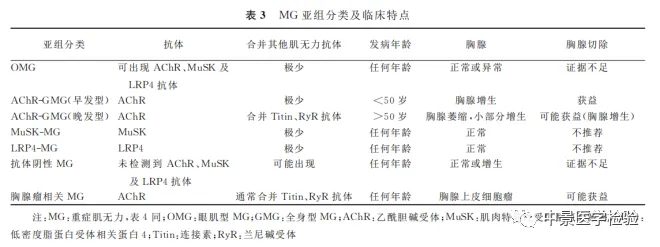
2.3.1 眼肌型MG(ocular MG,OMG):MGFA I型,可发生于任何年龄阶段。
(1)我国儿童及JMG以眼肌型为主,很少向全身型转化。
(2)成人发病的OMG,在眼肌症状出现2年内容易向全身型转化,亚裔人群2年自然转化率为23%-31%,低于西方人群(50%-80%)。
(3)合并胸腺瘤、异常重复神经电刺激(RNS)结果、AChR抗体阳性、病情严重的OMG更易发生转化。
(4)早期免疫抑制治疗减少OMG继发转化,部分儿童及青少年OMG可能会自行缓解。
2.3.2 AChR-全身型MG(generalized MG,GMG):该类患者血清AChR抗体阳性,无影像学怀疑或病理确诊的胸腺瘤;依据发病年龄可分为早发型MG(early-onset myasthenia gravis,EOMG)及晚发型MG(late-onset myasthenia gravis,LOMG)。
(1)EOMG是指首次发病在50岁之前,女性发病略高于男性,常合并胸腺增生,胸腺切除可获益,与HLA-DR3、HLA-B8以及其他自身免疫性疾病风险基因相关。
(2)LOMG是指首次发病在50岁以后,男性发病略高于女性,胸腺萎缩多见,少数伴胸腺增生的患者胸腺切除可能获益。
2.3.3 MuSK-MG:大约在1%-4%的MG患者血清中可检测到MuSK抗体。
(1)与AChR抗体(IgG1和IgG3)不同,绝大多数MuSK抗体属于IgG4亚型,其与AChR-IgG极少同时出现。
(2)MuSK-MG受累肌群较局限,以球部、颈部及呼吸肌受累为主,其次为眼外肌、四肢肌,主要表现为延髓性麻痹、面颈肌无力。
(3)MuSK-MG与HLA-DQ5相关,通常不伴胸腺异常。
2.3.4 LRP4-MG:在1%-5%的MG以及7%-33%的AChR、MuSK抗体阴性MG患者可检测出LRP4抗体。
(1)LRP4-MG的临床特点尚不完全明确,有研究表明该亚组患者临床症状较轻,部分患者可仅表现为眼外肌受累,很少出现肌无力危象。
(2)也有研究发现,LRP4抗体阳性患者均为GMG,表现为严重的肢带肌无力和/或进行性延髓麻痹。目前研究尚未发现LRP4-MG伴有胸腺异常。
2.3.5 抗体阴性MG:极少部分患者血清无上述可检测到的抗体,包括AChR、MuSK及LRP4抗体,称为抗体阴性MG。
2.3.6 胸腺瘤相关MG:约占MG患者的10%-15%,属于副肿瘤综合征,任何年龄均可发病,相对发病高峰在50岁左右。绝大多数胸腺瘤相关MG可检测出AChR抗体,除此之外,多合并连接素(Titin)抗体及RyR抗体,胸腺瘤相关MG病情略重,需要更长疗程免疫抑制治疗。
甲硫酸新斯的明试验:成人肌肉注射1.0-1.5mg,同时予以阿托品0.5mg肌肉注射,以消除其M胆碱样不良反应;儿童可按体重0.02-0.04mg/kg,最大用药剂量不超1.0mg。注射前可参照MG临床绝对评分标准,选取肌无力症状最明显的肌群,记录1次肌力,注射后每10min记录1次,持续记录60min。以改善最显著时的单项绝对分数,按照下列公式计算相对评分作为试验结果判定值。相对评分=(试验前该项记录评分-注射后每次记录评分)/试验前该项记录评分×100%。相对评分≤25%为阴性,25%-60%为可疑阳性,≥60%为阳性。
3.2.1 RNS:采用低频(2-3Hz)重复电刺激神经干,在相应肌肉记录复合肌肉动作电位(compound muscle action potentials,CMAP)。常规检测的神经包括面神经、副神经、腋神经和尺神经。持续时间为3s,结果以第4或第5波与第1波的波幅比值进行判断,波幅衰减10%以上为阳性,称为波幅递减。部分患者第4波后波幅不再降低和回升,形成U字样改变。服用胆碱酯酶抑制剂的患者需停药12-18h后进行检查,但需充分考虑病情。与突触前膜病变鉴别时需要进行高频RNS(30-50Hz)或者大力收缩后10s观察CMAP波幅变化,递增100%以上为异常,称为波幅递增。
3.2.2 单纤维肌电图(SFEMG):使用特殊的单纤维针电极测量同一神经肌纤维电位间的间隔是否延长来反映NMJ处的功能,通过测定“颤抖”(Jitter)研究神经-肌肉传递功能。“颤抖”一般为15-35μs,超过55μs为“颤抖增宽”,一块肌肉记录20个“颤抖”中有2个或2个以上大于55μs则为异常。检测过程中出现阻滞(block)也判定为异常。SFEMG并非常规的检测手段,敏感性高。SFEMG不受胆碱酯酶抑制剂影响,主要用于OMG或临床怀疑MG但RNS未见异常的患者。
3.3.1 抗AChR抗体:约50%-60%的OMG、85%-90%的GMG血清中可检测到AChR抗体。需注意的是AChR抗体检测结果为阴性时不能排除MG诊断。放射免疫沉淀法(radioimmunoprecipitation assay,RIA)是AChR抗体的标准检测方法,可进行定量检测。ELISA法较RIA法敏感性低。
3.3.2 抗MuSK抗体:在10%-20%的AChR抗体阴性MG患者血清中可检测到MuSK抗体,标准检测方法为RIA或ELISA。
3.3.3 抗LRP4抗体:在7%-33%的AChR、MuSK抗体阴性MG患者中可检测出LRP4抗体。
3.3.4 抗横纹肌抗体:包括抗Titin和RyR抗体。Titin抗体通常采用ELISA法检测,RyR抗体可采用免疫印迹法或ELISA法检测。
约80%左右的MG患者伴有胸腺异常,包括胸腺增生及胸腺瘤。CT为常规检测胸腺方法,胸腺瘤检出率可达94%;MR有助于区分一些微小胸腺瘤和以软组织包块为表现的胸腺增生;必要时可行CT增强扫描;PET-CT有助于区别胸腺癌和胸腺瘤。
MG患者可合并其他自身免疫病,如自身免疫性甲状腺疾病,最常见的是Graves病,其次为桥本甲状腺炎。OMG合并自身免疫性甲状腺疾病比例更高,因此,MG患者需常规筛查甲状腺功能及甲状腺自身抗体、甲状腺超声检查观察有无弥漫性甲状腺肿大,以及其他自身免疫性疾病相关抗体检测。



